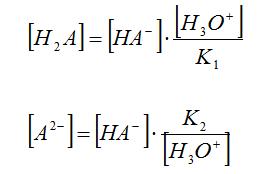DISSOLUCIONS REGULADORES, AMORTIGUADORES O TAMPÓ
Aquestes dissolucions són aquelles en les que pH apenes varia a l’afegir,
en xiquetes quantitats, altres electròlits que formen ions H3O+
(és a dir afegir àcid) o ions OH- (és a dir afegir base). Aquestes
dissolucions contenen dues espècies químiques d’una banda una que és capaç de
reaccionar amb els ions H3O+ quan s’afegeix un àcid, i d’una
altra l’altra espècie que es capaç de
reaccionar amb els ions OH- quan s’afegeix una base Estan
formades normalment per una cocentració elevada d'un àcid feble (per exemple àcid
acètic) i una sal de la seua base conjugada (per exemple acetat de sodi) o bé,
per una concentració de base feble (NH3) i d'una sal de la seua base
conjugada (sal d'amoni, NH4Cl). En la teoria de Brönsted-Lowry, una
dissolució d'àcid i la seua base conjugada en quantitats iguals tindria un pH
igual a seu pKa.
Considerem el cas d'una dissolució reguladora formada per àcid acètic i
acetat de sodi. Si a aquesta dissolució se li afegeix una certa quantitat de:
Es
esmorteeix l'efecte àcid originat per l'addició d'àcid, i
Es esmorteeix l'efecte alcalí originat per l'addició de base.
Exercici. Calculeu la concentració de totes les espècies en equilibri en dissoldre 0.26 mols de NaOH i 0.10 mols de H3PO4 en aigua, fins un volum final de 1.0 L. És una dissolució tampó?
Dades: pKi(H3PO4) = 2.15, 7.20 i 12.40.