FRACCIONS MOLARS DE LES ESPÈCIES (Secció Adicional)
Sistemes monopròtics
Suposem que tenim una dissolució constituïda
per Ca mols per litre de l’àcid HA i per Cb mols per
litre de la base conjugada A-. La concentració total del
sistema protolític és, per tant, Co
= Ca + Cb. Aquesta concentració total no canvia durant la
reacció, ja que l’àcid pot convertir-se en la base, o viceversa; la suma total,
però, de les dues concentracions serà sempre la mateixa, Co. D’altra
banda:
HA + H2O Û A- + H3O+
La constant de equilibri àcid i el balanç de masses són:
Anomenarem aHA i aA- a les fraccions molars de HA i A-, respectivament:
De l’equació de la constant d'equilibri resulta:
Si substituïm [HA] en les equacions aHA i aA- en resulta:
Per tant, si [H3O+]
> Ka , aHA > aA- , la qual cosa vol dir que l’espècie
àcida predomina sobre la bàsica. Si, pel contrari, [H3O+]
< Ka , aHA < aA-, i és l’espècie bàsica la que és
majoritària. En qualsevol situació, és clar que
aHA + aA- = 1. Les figures 1 i 2 representen, en forma lineal la primera i
logarítmica la segona, les variacions de aHA i de aA- en funció del pH per a un sistema de pKa
= 6.0.
Figura 1
Figura 2
Una vegada
conegudes les fraccions molars, les concentracions d’equilibri són calculades
molt fàcilment:
[HA] = aHA×Co ; [A-] = aA-×Co.
Encara que, en
aquest cas, hem considerat que la forma àcida era neutra (HA) i que la forma
bàsica era aniònica (A-), el resultat final que s’obté per
a les fraccions molars és independent de la càrrega dels protòlits implicats,
és a dir, obtindríem el mateix resultat per a un àcid catiònic o aniònic.
Sistemes dipròtics
Considerarem ara un
sistema dipròtic, constituït per l’àcid H2A, l’amfòlit HA- i la base A2-. La
dissolució contindria les concentracions analítiques següents (en mols per
litre): CH2A
de l’àcid, CHA- de l’amfòlit i CA2- de la base. Igual que adés:
D’altra banda, els equilibris de protòlisi del
sistema:
H2A + H2O Û HA- + H3O+
HA- + H2O Û A2- + H3O+
donen lloc a les constants següents:
Si aïllem [H2A] i [A2-] de les equacions de les constants en resulta:
i si substituïm en el balanç de masses:
Reordenant:
Si substituïm l’equació anterior en les equacions de [H2A] i [A2-] en resulta:
Si introduïm les fraccions molars dels
protòlits en el sistema protolític, s'hi obté:
Les figures 3 i 4 representen, en forma lineal la primera i logarítmica la segona, les
variacions de les fraccions molars dels protòlits amb el pH per a un sistema
amb K1 = 10-3 i K2 = 10-9.
Figura 3.
Figura 4,
Al DRIVE trobareu com calcular les fraccions molars de l'àcid cítric amb EXCEL









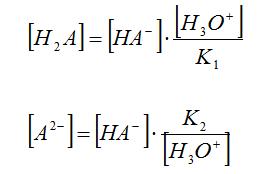






Cap comentari:
Publica un comentari a l'entrada
Comentaris